Il potenziale di riduzione standard (abbreviato Eo) è il potenziale elettrodico riferito all'elettrodo standard a idrogeno (a cui viene assegnato un potenziale Eo= 0,00 V) e misurato nello stato standard: alla pressione di 1 bar, ossia 100 kPa e ad attività unitaria. Nella maggior parte dei casi è possibile approssimare l'attività unitaria (a=1) con la concentrazione molare unitaria (concentrazione 1 M per ogni reagente e prodotto).
In biochimica, e più in generale in biologia, si è soliti definire il potenziale standard di riduzione a pH= 7 (pH dei sistemi biologici). Tale grandezza viene indicata come E' 0 .
Descrizione
Il potenziale standard di un elettrodo Eo e l'energia libera di Gibbs sono legati dall'equazione:
dove:
- è l'energia libera di Gibbs allo stato standard (in J/mol);
- n sono le moli di elettroni per mole di prodotti;
- F è la costante di Faraday, pari a circa 96485 C/mol.
Se la riduzione avviene in maniera spontanea il potenziale standard risulta positivo (essendo per un processo spontaneo), mentre se la riduzione avviene in maniera non spontanea il potenziale standard risulta negativo (essendo per un processo non spontaneo).
I potenziali standard dell'elettrodo possono essere ottenuti per:
- potenziali dell'elettrodo misurati sperimentalmente e ricalcolati con l'equazione di Nernst (soltanto per reazioni reversibili);
- calcolo dell'energia libera di Gibbs della semireazione.
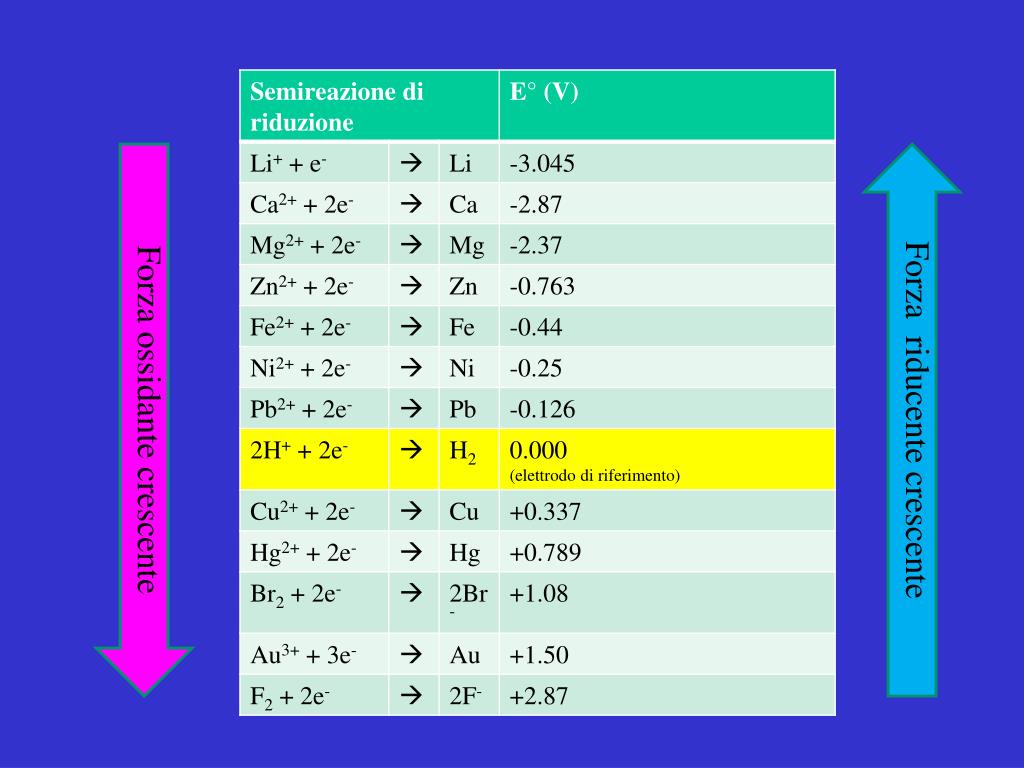
La valutazione dei potenziali standard è molto utile per determinare se una reazione redox possa avvenire in condizioni spontanee o meno. Le specie chimiche che possiedono potenziale più alto tendono a ossidare quelle a potenziale più basso: ad esempio l'acido cloridrico è in grado di ossidare (ox) la limatura di ferro in quanto H , con potenziale di 0 V, è in grado di acquisire elettroni dal ferro, che possiede potenziale -0,41 V, producendo idrogeno gassoso e ioni Fe2 .
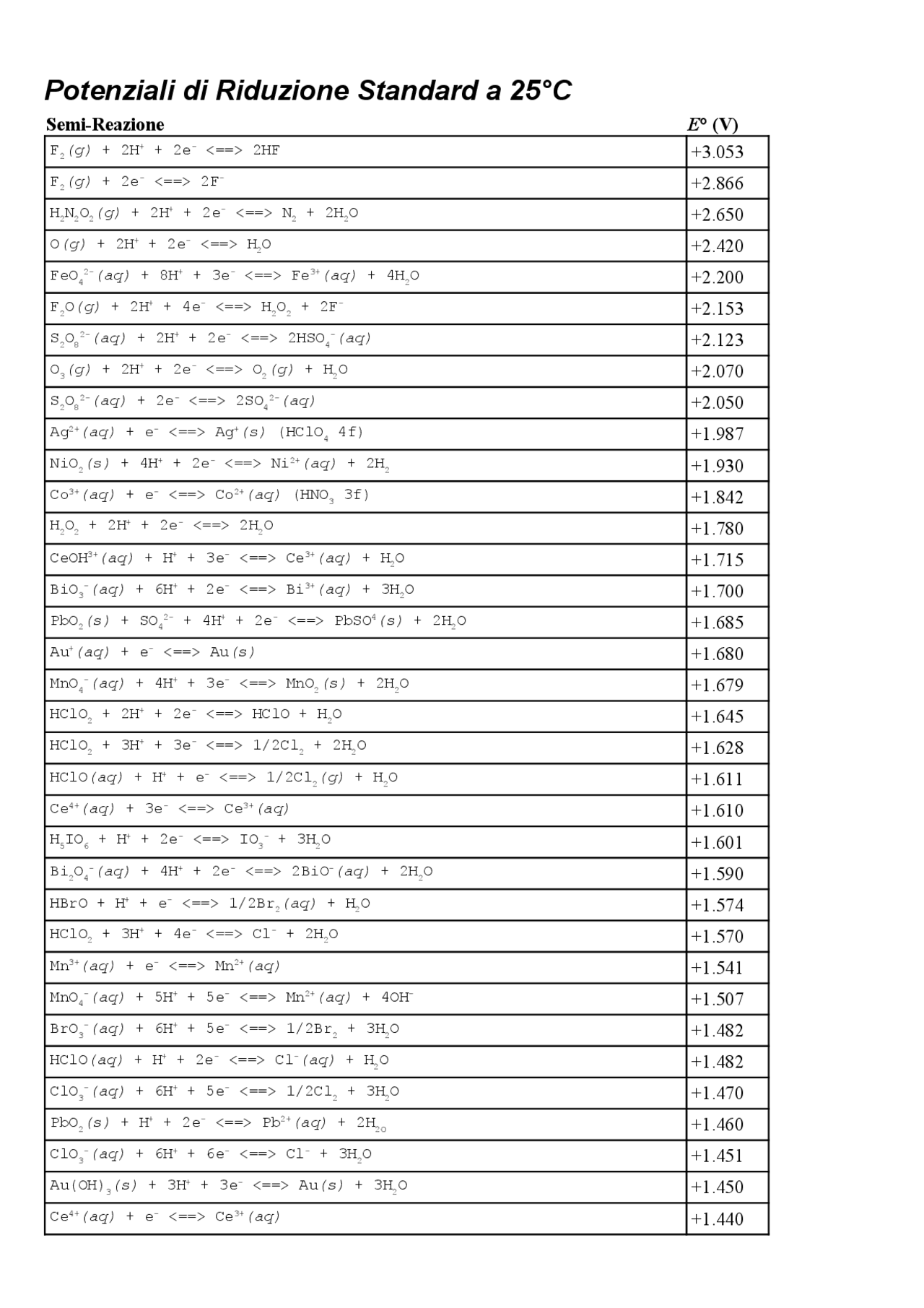
Valori di potenziali standard
Nella tabella seguente vengono indicati alcuni valori dei potenziali standard:
Note
Bibliografia
- (EN) Cynthia G. Zoski, Handbook of Electrochemistry, Elsevier Science, 2007, ISBN 978-0-444-51958-0.
- Aldo Gaudiano, Giorgio Gaudiano, Vademecum di Chimica, 2ª ed., Zanichelli, 1998 [1982], ISBN 88-08-09499-5.
- Lincoln Taiz, Eduardo Zeiger, Fisiologia Vegetale, 3ª ed., Piccin, 2006, ISBN 978-88-299-1974-1
Voci correlate
- Potenziale di cella
- Potenziale di elettrodo
- Potenziale di riduzione
- Diagramma di Frost
- Diagramma di Latimer
- Diagramma di Pourbaix
Collegamenti esterni
- Tavola dei potenziali standard di riduzione, su itchiavari.org.
- Tavola dei potenziali standard di riduzione in ordine alfabetico per elemento, su itchiavari.org.